Klinische Studien sind ein wichtiger Teil der Krebsforschung und spielen eine große Rolle für die Entwicklung von neuen Medikamenten. Hier finden Sie die wichtigsten Fragen und Antworten aus der Online-Schulung „Klinische Studien bei Krebs“ übersichtlich zusammengefasst.
Klinische Studien verstehen
Warum werden klinische Studien durchgeführt?
Klinische Studien werden durchgeführt, um neue Medikamente oder Therapieformen einer breiten Patientenpopulation zur Verfügung zu stellen. Erst nach einer Zulassung durch die Behörden und diese fußt auf klinischen Studien verschiedener Phasen, kann ein Medikament in der Routine verwendet werden.
Klinische Studien gibt es in verschiedenen Phasen, in der ersten Phase wird vor allem die Sicherheit geprüft. In der dritten Phase wird die Effizienz im Vergleich zu einer Standardtherapie untersucht.
Was ist eine klinische Studie?
Bei einer klinischen Studie handelt es sich um die Prüfung eines neuen Behandlungsverfahrens, das heißt eines neuen Medikaments oder einer neuen Methode, zur Verbesserung der Therapieoptionen von Patienten.
Durchgeführt werden die Studien meist von großen Arzneimittelkonzernen oder kleinen Studiengruppen. Sie dienen zur Prüfung der Wirksamkeit, der Nebenwirkungen und der Sicherheit eines Medikaments oder einer Behandlung.
Welche Arten von klinischen Studien gibt es?
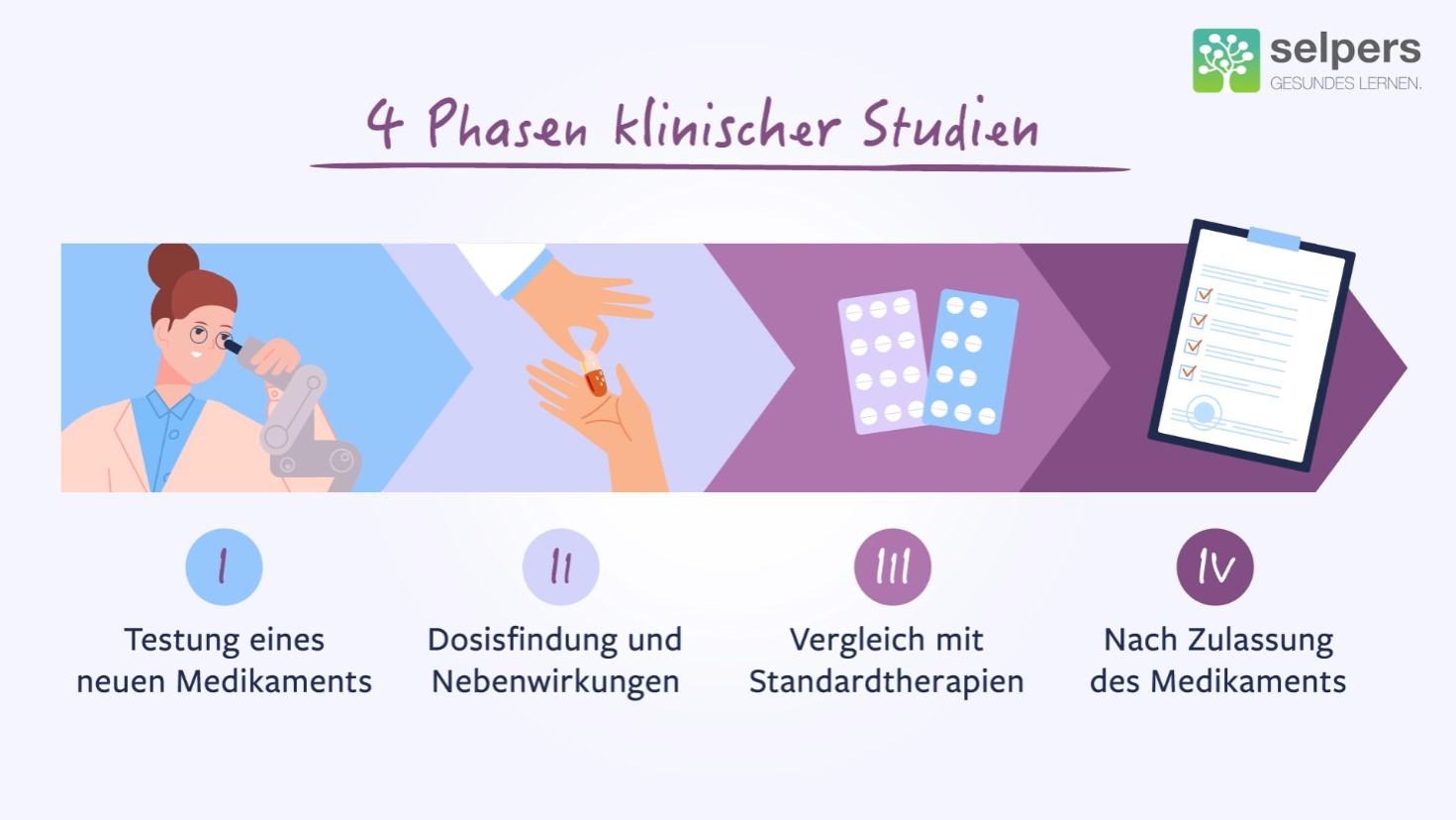
Es gibt prinzipiell vier Phasen von klinischen Studien mit einzelnen Überlappungen. In der Phase eins wird ein neues Medikament das erste Mal an Menschen getestet. Hier geht es vor allem um die Sicherheitsaspekte.
In den Phasen eins bis zwei wird die entsprechende Dosis gesucht, nämlich die Dosis mit der größtmöglichen Effizienz und der möglichst niedrigsten Nebenwirkungsrate.
In einer Phase drei wird die neue Therapie mit Standardtherapien verglichen, um zu kontrollieren, dass diese für den Patienten auch signifikant besser ist. Nach der Zulassung gibt es sogenannte Phase vier Studien, bei denen noch zusätzliche klinische Daten generiert werden sollen.
Hier geht es zum Video-Interview: „Klinische Studien verstehen“
Klinische Studien bei Krebs
Was gilt für klinische Studien speziell bei Krebs?
Bei klinischen Studien zu Krebserkrankungen wird der aktuelle Standard gegen eine neue Therapieform geprüft. Es ist möglich, dass Sie eine Standardtherapie und ein Placebo , das heißt ein nicht wirksames Medikament bekommen oder die Standardtherapie mit einem neuen Medikament.
Welche Vorteile kann es für mich haben, wenn ich an einer klinischen Studie teilnehme?
Wenn Sie an einer klinischen Studie teilnehmen, hat das natürlich auch einige Vorteile für Sie. Sie werden meist vom selben Arzt behandelt, das heißt vom selben Prüfarzt. Sie bekommen vorab, vor allen anderen Patienten, Zugang zu neuen Medikamenten. Sie haben, sofern das Studienzentrum auch ein Studienbüro besitzt, eine zentrale Anlaufstelle, die sämtliche Termine für Sie koordiniert und Sie werden besser überwacht.
Welche Nachteile kann die Teilnahme an einer klinischen Studie für mich haben?
Wenn ein Patient bereit ist an einer klinischen Studie teilzunehmen, hat er grundsätzlich den Vorteil, dass im Rahmen einer klinischen Studie eine genaue Kontrolle des Patienten erfolgt. Er wird nur von Prüfärzten begutachtet, das heißt es gibt keine große Ärztefluktuation.
Natürlich kann der Patient in den Kontrollarm randomisiert werden, denn Phase drei Stunden sind überwiegend randomisiert. Dieser Kontrollarm kann entweder die Standardtherapie zum jetzigen Zeitpunkt sein oder wenn dieser nur aus Beobachtung besteht, kann es auch nur eine Beobachtung sein.
Natürlich kann das im schlechtesten Fall zum Standard der Therapie führen. Zusätzlich sollte noch erwähnt werden, dass jeder Patient jederzeit sein Einverständnis zurückziehen kann.
Hier geht es zum Video-Interview: „Klinische Studien bei Krebs“
An klinischen Studien teilnehmen
Wer kann an klinischen Studien zu Krebstherapien teilnehmen?
Klinische Studien laufen immer nach einem vorgegebenen Protokoll ab. In diesem Protokoll wird auch beschrieben, welche Patienten an der Studie teilnehmen dürfen.
Wenn Sie Interesse an der Teilnahme an einer klinischen Studie haben, dann fragen Sie Ihren Arzt, ob Sie für diese geeignet sind. Er wird Sie darauf prüfen oder an das Studienzentrum überweisen.
Wie kann ich mich über laufende klinische Studien informieren?
Ich kann nur für den hämatoonkologischen Bereich sprechen, hier gibt es zumindest in Österreich große Selbsthilfegruppen. Diese haben die Kontaktdaten von Kontroll- und Prüfärzten, welche einen entsprechenden Zugang zu klinischen Studien haben.
Darüber hinaus gibt es auch die Möglichkeit, sich auf einer internationalen Website alle laufen klinischen Studien anzusehen. Das ist für den Patienten aber wahrscheinlich nicht der gängigste Weg.
Wenn Sie bereits an einem Zentrum in Betreuung sind, können Sie sich an den Arzt Ihres Vertrauens wenden. Dieser weiß entweder, welche Studien aktuell zu dieser Krankheit laufen oder zumindest, wen er dazu befragen kann.
Wie werde ich Proband:in einer klinischen Studie?
Um an einer klinischen Studie teilnehmen zu können, müssen Sie zuerst ausführlich von Ihrem Arzt aufgeklärt werden. Das kann Ihr aktuell behandelnder Arzt oder ein neuer Prüfarzt sein.
Sie werden zuerst auf die Eignung geprüft. Dafür werden spezielle Untersuchungen durchgeführt, um zu sehen, ob Sie an der Studie teilnehmen können. Wenn alle Teilnahmevoraussetzungen erfüllt sind, können Sie mit der Studie starten.
Hier geht es zum Video-Interview: „An klinischen Studien teilnehmen“
Ablauf von klinischen Studien
Wie läuft eine klinische Studie ab?
Bevor Sie mit einer klinischen Studie starten können, werden Sie zuerst ausführlich von einem Studienarzt über diese aufgeklärt. Danach erhalten Sie einige Bedenkzeit. Wenn Sie sich danach entscheiden sollten, an den Studien teilnehmen zu wollen, dann werden Screening Untersuchungen durchgeführt.
Das sind spezielle Untersuchungen, um Sie auf die Eignung für die Teilnahme an der klinischen Studie zu prüfen. Sobald alle Untersuchungen abgeschlossen und alle Einschlusskriterien erfüllt sind, können Sie mit der Studie, also mit der Behandlung starten.
Wenn Sie an einer klinischen Studie teilnehmen, hängt die Dauer sehr vom Patienten selbst ab. Am Anfang sind die Visiten recht eng gesteckt, im Laufe der Zeit werden die Abstände länger. Wenn Sie von dem Medikament profitieren, läuft die Studie länger, wenn Sie nicht davon profitieren, wird sie vorzeitig abgebrochen.
Wie wird sichergestellt, dass die klinische Studie korrekt abläuft?
Bevor eine klinische Studie in einem Land starten kann, muss sie von der zentralen Ethikkommission genehmigt werden. Diese besteht aus Ärzte, Juristen, Philosophen und auch Theologen, welche beurteilen, ob die Durchführung der Studie für den Patienten überhaupt sicher ist.
Im Laufe der Studie, wenn bereits mehrere Patienten eingeschlossen wurden, gibt es regelmäßige Sicherheitskontrollen von verschiedenen Ärzten. Diese beurteilen, ob die Studie sicher ist und ein Weiterführen sinnvoll ist.

Bekomme ich die bestmögliche Behandlung für meine Erkrankung, auch wenn ich in der Kontrollgruppe bin?
Wenn Sie sich entschieden haben, an einer klinischen Studie teilzunehmen und in den randomisiert Kontrollarm zugeteilt werden, also zufällig, dann kann es sein, dass Sie vielleicht nicht den aktuellen Standard der Wissenschaft erhalten. Das hängt vor allem davon ab, ob es pharmazeutisch betriebene Studien sind oder akademische Studien.
Bei akademischen Studien wird mehr Wert darauf gelegt, dass der Kontrollarm dem letzten Stand der Wissenschaft entspricht. In pharmazeutischen Studien geht es vor allem um zulassungsrelevante Aspekte. Hier kann es beispielsweise darum gehen, den global am kleinsten, gemeinsamen Nenner als Kontrollarm zu finden, sodass Sie vielleicht eine Therapie bekommen, die nicht ganz der Aktualität entspricht.
Hier geht es zum Video-Interview: „Ablauf von klinischen Studien“
Alltag als Teilnehmer:in einer klinischen Studie
Wo werden klinische Studien durchgeführt?
Wenn Sie an einer klinischen Studie teilnehmen, haben Sie entweder die Option, dies in einem großen Krankenhaus oder in einzelnen niedergelassenen Arztpraxen zu machen.
Wenn Sie in einem großen Krankenhaus in Behandlung sind, haben Sie den Vorteil, dass die meisten Wege recht kurz sind. Wenn Sie zu verschiedenen Behandlungen geschickt werden, müssen Sie nur einmal den ganzen Umlauf im Spital machen.
Bei Arztpraxen kann es sein, dass Sie manche Untersuchungen auswärts, das heißt an anderen Instituten machen müssen.
Was bedeutet die Teilnahme an einer klinischen Studie für meinen Alltag?
Sollten Sie sich entscheiden an einer klinischen Studie teilzunehmen, für mich betreffend vor allem im hämatoonkologischen Bereich, bei lymphatischen Systemerkrankungen, bedeutet das, dass im Laufe der aktiven Therapie üblicherweise alle vier Wochen eine klinische Visite stattfindet. Nach Abschluss der Therapie finden die Kontrollen meist alle drei Monate statt.
Sie gehen dafür immer zu einem der Prüfärzte, das ist eine überschaubare Anzahl an Spezialisten. Zudem kann es sein, dass Sie Patiententagebücher führen müssen, entweder analog oder in letzter Zeit zunehmend digital, mit Tablets oder anderen elektronischen Geräten.
Insgesamt ist der Aufwand etwas höher als im klinischen Alltag, da die Visiten im klinischen Alltag mit etwas längeren Zeitabständen stattfinden.
Was kann mir helfen mich an anstehende Befragungen, Untersuchungen etc. zu erinnern?
Um Ihnen den Alltag mit einer klinischen Studie zu erleichtern, gibt es das Studienbüro. Wir machen Ihnen gerne Termine aus, erinnern Sie an die nächste Visite oder helfen Ihnen bei der Organisation rund um die Studie.
Fallen während der klinischen Studie zusätzliche Kosten für mich an?
Wenn Sie an einer klinischen Studie teilnehmen, dann ist es mittlerweile so, dass die Sponsoren der Studie beispielsweise die Fahrtkosten und andere Spesen übernehmen. Das wird meistens im Nachhinein über Honorarnoten refundiert.
Hier geht es zum Video-Interview: „Alltag als Teilnehmer:in einer klinischen Studie“
Meine Rechte und Pflichten als Studienteilnehmer:in
Was sind meine Rechte als Proband:in einer klinischen Studie?
Wenn Sie sich dazu bereit erklärt haben, an einer klinischen Studie teilzunehmen, dann beginnt der Ablauf mit einer Einverständniserklärung. Diese ist nach einer entsprechen langen Bedenkzeit mit dem Namen, der Unterschrift und dem aktuellen Datum des Prüfarztes und des Probanden zu unterschreiben.
Anschließend erhalten Sie in jeder klinischen Studie, zumindest im Phase drei Setting und sobald es über eine monozentrische Studie hinausgeht, eine entsprechende Versicherung. Falls Ihnen durch irgendwelche Umstände ein Schaden entsteht, dann wird dieser natürlich vollkommen ausgeglichen.
Wie werden meine Daten im Zuge der klinischen Studie behandelt?
Klinische Studien unterliegen der Datenschutzgrundverordnung, das heißt es werden keine Namen oder Initialen verwendet. Die Patientendaten werden pseudonymisiert, sodass es nur für die Studienleitung möglich ist den Probanden zu identifizieren, aber sonst für niemanden.
Welche Pflichten habe ich als Teilnehmer:in einer klinischen Studie?
Wenn Sie an einer klinischen Studie teilnehmen, dann verpflichten Sie sich dazu, dem Studienzentrum einige Informationen über sich bereitzustellen.
Das sind Informationen zu Auslandsaufenthalten, einem Wohnortswechsel, Nebenwirkungen, die Sie beobachtet haben oder beispielsweise eine neue Begleitmedikation, die Sie bekommen.
Es ist auch wichtig stationäre Krankenhausaufenthalte in anderen Krankenhäusern anzugeben, da wir eine Meldepflicht gegenüber den Behörden haben.

Kann ich meine Teilnahme an einer klinischen Studie vorzeitig beenden?
Sollten Sie an einer klinischen Studie teilnehmen und mit dem Verlauf oder dem Therapieerfolg unzufrieden sein, dann besteht jederzeit die Möglichkeit das Einverständnis zurückzuziehen.
Eine klinische Studie ist ein Vertrag zwischen dem Studienleiter und dem Patienten, sowie den Sponsoren, der immer einseitig gekündigt werden kann. Sollten nach dem Ausstieg aus der Studie weitere Behandlungen notwendig sein, dann würden Sie nach dem aktuellen Stand der Wissenschaft weiter behandelt werden.
Hier geht es zum Video-Interview: „Meine Rechte und Pflichten als Studienteilnehmer:in“
Ergebnisse der klinischen Studie
Werde ich als Studienteilnehmer:in über die Ergebnisse informiert?
Wenn Sie an einer klinischen Studie teilnehmen und diese abgeschlossen ist, dann kann es sein, dass die Studie positiv oder negativ ausgefallen ist. Das heißt, dass die geprüfte Substanz oder Therapieformen einen Vorteil oder keinen Vorteil gegenüber bereits etablierten Behandlungen erbracht hat.
Üblicherweise münden solche Studien in diversen Präsentationen bei Kongressen, Publikationen in entsprechenden Fachjournalen und optimalerweise auch in Zulassungen für die entsprechenden Therapien.
Sollte die Studie akademisch sein, sind die Daten auch vorzeitig und leichter zu erhalten, als wenn die Studie von einer pharmazeutischen Firma gesponsert ist. Prinzipiell versuche ich allen meine Patienten im Nachhinein entsprechende Publikationen zumindest mündlich mitzuteilen und bei Bedarf die entsprechende Publikation auszuteilen. Das ist möglich, da die Patienten alle zur Nachsorge kommen, sie werden nachbeobachtet, größtenteils von mir selbst.
Wie lange dauert es, bis das getestete Medikament zugelassen ist und angewendet wird?
Die Ergebnisse einer Studie hängen von der Krankheit ab. Es gibt chronische Erkrankungen, bei denen sich der Vorteil einer Therapieform erst nach Jahren des Vergleiches zeigt. Es gibt aber auch akute Erkrankungen, zum Beispiel die akuten Leukämien, bei denen sich der Vorteil rasch, nach einem halben oder einem Jahr zeigt.
Dementsprechend dauert es kürzer oder länger, bis sich ein entsprechender Therapieerfolg der experimentellen Kombination in einer Verfügbarkeit für die Allgemeinheit niederschlägt. Das kann zwischen zwei und fünf Jahren dauern.
Bekomme ich als Teilnehmer:in das getestete Medikament nach Ablauf der Studie?
In einer klinischen Studie ist es normalerweise nicht üblich, dass Patienten das Medikament nach Ablauf erhalten. Wenn der Sponsor allerdings bestätigt, dass Sie von der Einnahme des Medikaments profitieren, kann es Ihnen weiter zur Verfügung gestellt werden.
Hier geht es zum Video-Interview: „Ergebnisse der klinischen Studie“

